Hola a tod@s.
Para hacer un poco mas llevadera la situación y al no poder desplazarnos al monte a por muestras (no está permitido aun en la Fase 1), creo que es la ocasión de trabajar con temas que en su momento no pude identificar por razones diversas, como falta de tiempo o ideas.
El primero un pequeño Pluteus del 27 de Octubre de 2019 sobre un tronco ya bastante degradado de Populus, aunque el ejemplar era inmaduro y no pude obtener esporas, por sus especiales características tengo bastante claro que tiene que tratarse del
Pluteus aurantiorugosus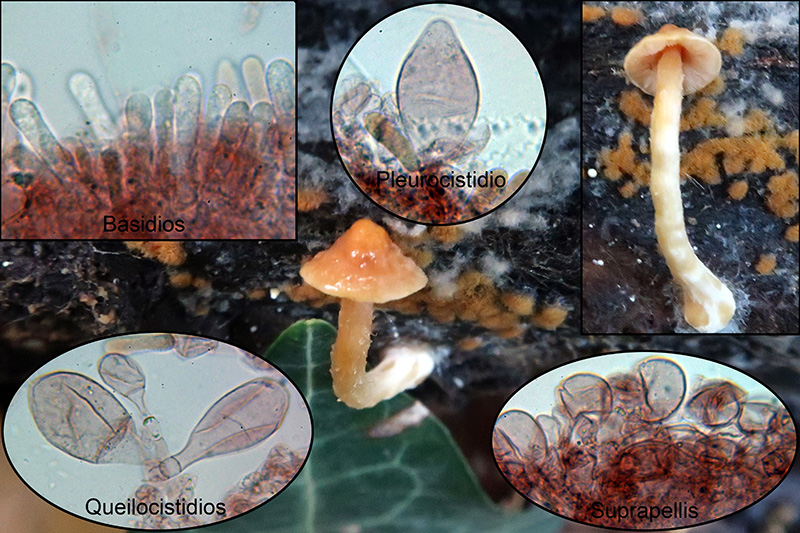
Uno del 25 de Diciembre de 2019, sobre hojas del suelo de
Buxus sempervirens, aunque se considera bastante común se me resistía, la Ceuthospora buxi, actualmente denominada,
Blennoria buxi
Una en la que el desenlace ha sido desconcertante, las imágenes son de un Poliporal sobre un tronco tomadas el 9 de Noviembre de 2019, llevo visitando la zona donde recogí la muestra muchos años y no he visto nunca nada que no sea Buxus sempervirens y Pinus pinaster, aunque cuando vaya de nuevo a la zona voy a prestar una especial atención a la flora del sotobosque, ya que la secuenciación de la muestra ha determinado que se trata con un 100% de coincidencias de la
Coriolopsis gallica. La Coriolopsis gallica ya he estudiado en un par de ocasiones con el micro, siempre de muestras obtenidas en una ocasión en soto fluvial y la otra en un árbol ornamental de mi ciudad.
También indicar que Ryvarden en ningun momento la sitúa sobre Pinus y tampoco Buxus, otro dato que no encaja es el tamaño esporal que Ryvarden lo sitúa en 10-16 x 3-5 μm. y en mi caso las esporas obtenidas además por esporulación natural medían (7.4) 7.6 - 9.2 (9.6) × (2.7) 2.9 - 3.5 (3.7) µm, ninguna de ellas llegaba a las 10 µm.

Seguimos con una especie fotografiada el 29 de septiembre de 2019, en un tronco de probablemente
Crataegus monogyna. En conversación privada con Jacques Fournier el se inclina en que mi estudio se trataría probablemente de un Diatrype, de especies de Diatrype con medidas esporales parecidas tenemos la Diatrype stigmatoides, al parecer exclusiva de Quercus, la Diatrype spilomea que la sitúan sobre Acer y la Diatrype undulata exclusiva de Betula, ninguna sobre Crataegus, aun con todos los datos en esta ocasión no puedo pasar de
Diatrype sp. Es curioso mando a secuenciar muchas especies banales y olvido las verdaderamente interesantes, aunque conozco perfectamente el lugar de recogida y no descarto nuevos estudios.

Uno con el que me surgen algunas dudas ya tan solo por su aspecto, este recogido el 19 de Mayo de 2019, aunque por la microscopía obtenida todo apunta a Fibulomyces mutabilis, en espera de nuevos estudios lo dejo de momento como
Fibulomyces cf. mutabilis
Una Galerina del 1 de Noviembre de 2019, que a pesar de no presentar anillo, todos los parámetros y en especial los queilocistidios con unas medidas de (41.1) 46.3 - 65.3 (65,8) × (6.3) 6.5 - 10.6 (11.1) µm, así como las claves del género me llevan solo a la
Galerina uncialis.

También me encontré entre los estudios pendientes algunos de conocidos, por un lado el Megalocystidium luridum fotografiado el 17 de Noviembre de 2019, actualmente denominado
Gloeocystidiellum luridum
Y por otro lado un Ganoderma del 29 de Septiembre de 2019, que me llevé una muestra solo por brotar sobre un tocón de Pinus sylvestris y tenía muy claro que no se trataba de Ganoderma carnosum, dado el pequeño tamaño de las pocas esporas obtenidas, las claves de Ryvarden me llevan al
Ganoderma applanatum, según el mismo Ryvarden el Ganoderma applanatum puede aparecer de manera excepcional sobre madera de coníferas (
Abies, Pinus y Picea), dato que desconocía por completo.

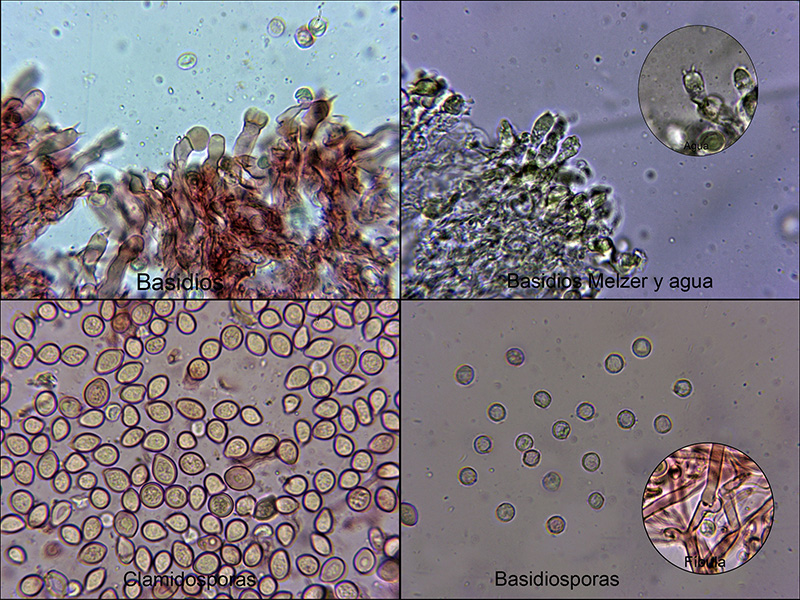
Un Corticial fotografiado el 19 de Mayo de 2019, sobre un tronco tumbado (probable Alnus glutinosa) y en cauce fluvial. Todo parece encajar a la perfección con el
Granulobasidium vellereum, lo único que me suscita alguna duda son los basidios que en solución de Rojo Congo diluido no presentan las granulaciones en su interior que dan orígen a su nombre, estas granulaciones por contra son bien visibles en agua destilada y en Melzer.

Un par de Hyphodermas que me faltaban para la colección, por un lado uno del 12 de Mayo de 2019, el
Hyphoderma litschaueri
Y por otro lado otro del 24 de Noviembre de 2019, el Hyphoderma puberum, actualmente denominado
Peniophorella pubera
Uno del 8 de Septiembre de 2019, que aunque no termina de encajarme la longitud de los cistidios (en mi estudio el mayor de 97 µm. y según bibliografía de entre 80 y 200 µm.), por sus peculiares esporas no encuentro nada mas parecido a mi estudio que la
Jaapia ochroleuca
Una Lepiota fotografiada el 8 de Diciembre en el Entorno Mirandés, la pobre ya no estaba en su mejor momento lo que hace mas difícil su correcta identificación, con unos queilocistidios de (17.3) 19.3 - 26.1 (28) × 9.1 - 10.8 (11) µm. , esporas con unas medidas de (5.2) 6.3 - 8 (8.4) × (3.2) 3.3 - 4.2 (4.5) µm. y la morfología de la pileipellis, las claves de FungaNordica me llevan a la
Lepiota xanthophylla
Una complicada Mollisia, en soto fluvial, fotografiada sobre un tronco tumbado donde predominaban los Alnus y Populus. Pequeños apotecios de 0.7 a 1.7 mm. con forma de disco con tendencia a deformarse por presión de unos ejemplos con otros, color gris azulado con el borde ligeramente más oscuro.
Pelos marginales cortos, con ninguno o un solo septo, terminando en formas redondeadas y con unas medidas desde 9.1 - 16.1 × (3.5) 3.52 - 4.6 µm. Excípulo ectal de textura globosa, con células ligeramente pigmentadas y unas medidas de (7.9) 8.5 - 10.4 (11,8) × (7.5) 7.7 - 9.6 (10.1) µm. Ascas octospóricas, biseriadas, con reacción del dispositivo amiloide apical tanto al Melzer como al IKI, con croziers (+), y unas medidas de (41) 42.6 - 54.8 (55,8) × (4.4) 4.7 - 5.6 (6) µm. Paráfisis filiformes, sin ensanchamientos, terminando en formas redondeadas, con contenido en su interior mas visible en IKI, sobresaliendo por encima del nivel de las ascas y con unas medidas de (49.5) 49.9 - 63.9 (65,8) × (2.7) 2.9 - 3.5 (3,7) µm. Ascosporas con poco contenido de aceite (0-1) y con unas medidas de esporas obtenidas por esporulación natural de (7.2) 7.4 - 9.4 (9,8) × (2.2) 2.23 - 2.6 (2.9) µm. Por la no reacción al KOH al aplicarlo directamente sobre los apotecios, como todos los demás datos obtenidos me hacen pensar en la Mollisa cinerea, lo único que no termina de encajar con la especie son al parecer las diminutas gotas de aceite en las ascosporas, que deberían ser completamente lisas (aceite 0), así que queda a falta de secuenciación como
Mollisia cf. cinerea

Una Nemania que me faltaba para la colección fotografiada el 25 de Agosto de 2019, por sus características y principalmente por las medidas del aparato apical, las Claves Europeas del género me llevan sin dejar dudas a la
Nemania confluens
También un Phanerochaete fotografiado el 22 de Septiembre de 2019 que me faltaba, el
Phanerochaete calotricha
Una Psathyrella, fotografiada el 24 de Noviembre de 2019, en suelo calcáreo arenoso y entre restos de caña común. Con sombrero de 2 a 3 cm. con fibrillas radiales y mas oscuro en el centro. Con queilocistidios con unas medidas de (22.9) 23 - 35.1 (40.1) × (8,8) 9.8 - 15.6 (15,8) µm, pleurocistidios presentes con unas medidas de 49.7 - 51.46 (51.5) × (10,8) 10.82 - 13.6 µm. y esporas elipsoides, con poro germinal central, algunas deprimidas por un lado y unas medidas de (7.3) 7.8 - 9 (9.2) × 4.4 - 4.8 (4.9) µm.
Atendiendo a las claves de Andreas Melzer, sitúa mi especie entre la Psathyrella arenosa y la muy parecida Psathyrella madida (asociada a Phragmites), aunque mas cerca de la primera, atendiendo al suelo y la microscopía obtenida queda pues como muy probable
Psathyrella arenosa
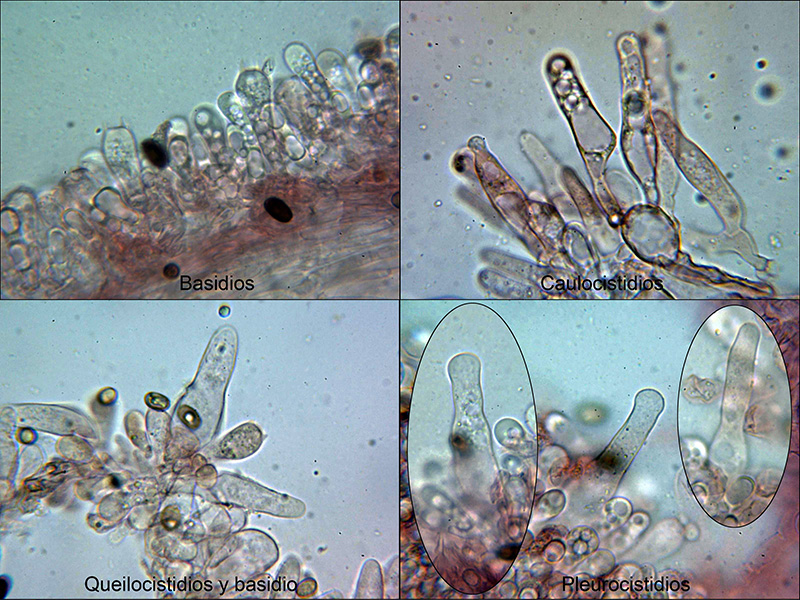
Y para terminar una mas desconcertante aun que la Coriolopsis gallica. Las imágenes tomadas el 1 de Diciembre de 2019 sobre una piña de conífera, en esta ocasión al mandar a secuenciar la muestra ya indiqué en mi correo a Pablo que la microscopía encajaba a la perfección con la de Radulomyces confluens, aunque por su aspecto y el sustrato donde aparecía la tuve que descartar. De nuevo la secuenciación ha determinado que efectivamente se trataba de
Radulomyces confluens.
Ningún autor sitúa a la Radulomyces confluens sobre madera de coníferas y mucho menos ya sobre una piña.

Saludos a tod@s